L'oxygène et la lumière du soleil font partie des nombreux facteurs qui endommagent quotidiennement notre ADN. Généralement, ces ruptures génétiques sont efficacement réparées dans nos cellules saines par des mécanismes épigénétiques et moléculaires distincts. Cependant, si les dommages sont accablants ou les réparations imparfaites, des mutations génomiques surviennent.
Les tumeurs les plus agressives présentent souvent des défauts dans leur capacité à réparer l'ADN. Par conséquent, ces cellules cancéreuses ont un taux de mutation élevé qui leur permet de surmonter rapidement les immenses pressions sélectives du corps humain. Cependant, des découvertes récentes sur le processus épigénétique derrière cet avantage évolutif permettent désormais à la médecine moderne d’en prendre avantage elle aussi.
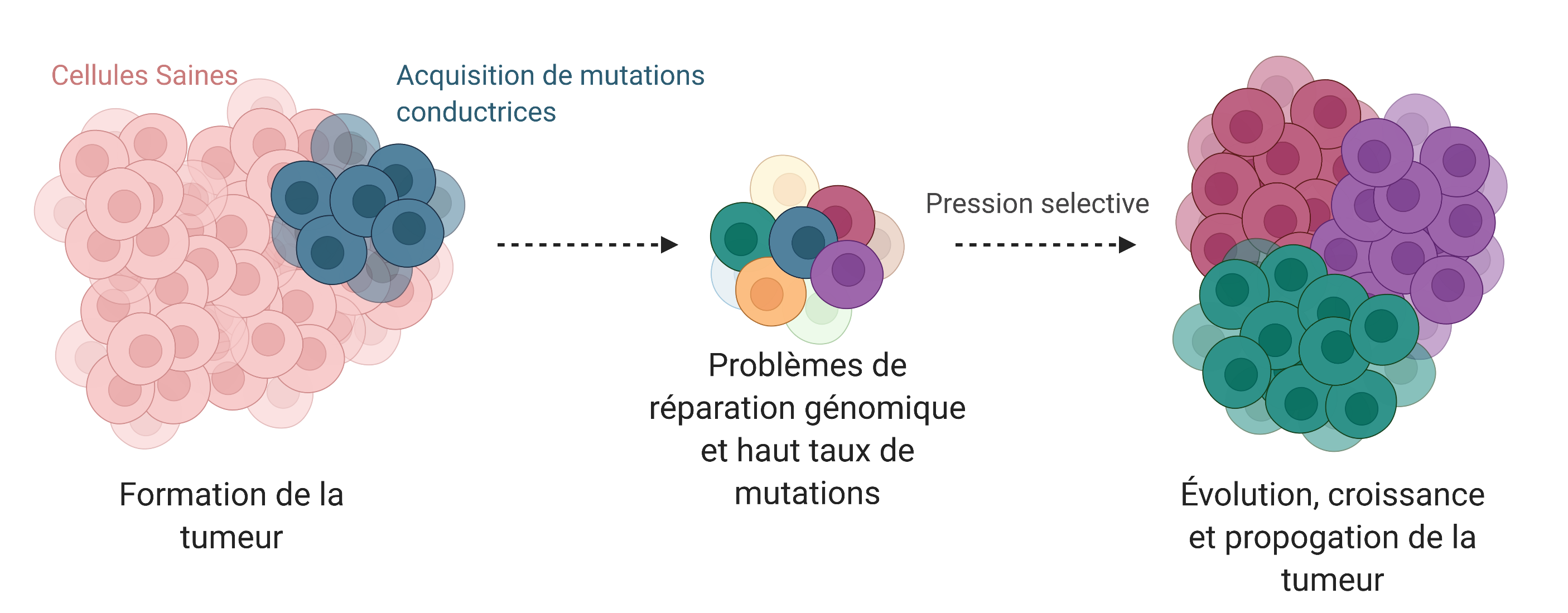
Initiation de la tumeur
La plupart des mutations n'auront aucun effet notable sur la tumeur, à moins qu'elles n'affectent la fonction d'un gène favorisant ou protégeant contre le cancer, ou la fonction d’éléments non codants qui régulent ces gènes. Ces mutations, appelées mutations conductrices, donnent aux cellules des intentions rebelles, leur permettant de croître plus rapidement, ignorer leurs voisins et s'approprier l'espace cellulaire environnant pour devenir une tumeur. Dans ces premiers stades, notre système immunitaire, avec l’aide de mécanismes cellulaires de suppression de tumeurs intrinsèques et extrinsèques, empêchera rapidement l'expansion des cellules mutées. Par conséquent, de nombreuses jeunes tumeurs ne survivront pas assez longtemps pour être remarquées. Cependant, les tumeurs qui pourront surmonter ces obstacles nous démontrent que la clé de la croissance et de la propagation du cancer est une évolution rapide.
Évolution de la tumeur
Plusieurs mutations conductrices perturbent les mécanismes de réparation d'ADN. Elles peuvent affecter les protéines qui réparent activement l'ADN ou les effecteurs épigénétiques qui ciblent et régulent l'activité de ces protéines. Dans les deux cas, de telles mutations favorisent un taux de mutation énorme. Par conséquent, il augmente considérablement la probabilité de générer de nouvelles mutations conductrices. Au fur et à mesure que de nouvelles mutations avantageuses s'accumulent avec les plus anciennes, les cellules cancéreuses s'adaptent et prospèrent dans l'environnement hautement sélectif, en constant changement, qu'elles occupent.
Cependant, l'avantage évolutif des cancers hautement mutatifs a un coût. En effet, ils dépendent fortement des mécanismes complémentaires de réparation de l'ADN qu'ils utilisent encore pour maintenir un niveau minimal de réparation de l'ADN suffisant pour survivre et proliférer massivement. Faisant de leurs mécanismes de réparation de l'ADN défectueux l'une de leurs plus grandes faiblesses.
Le talon d'Achille du cancer?
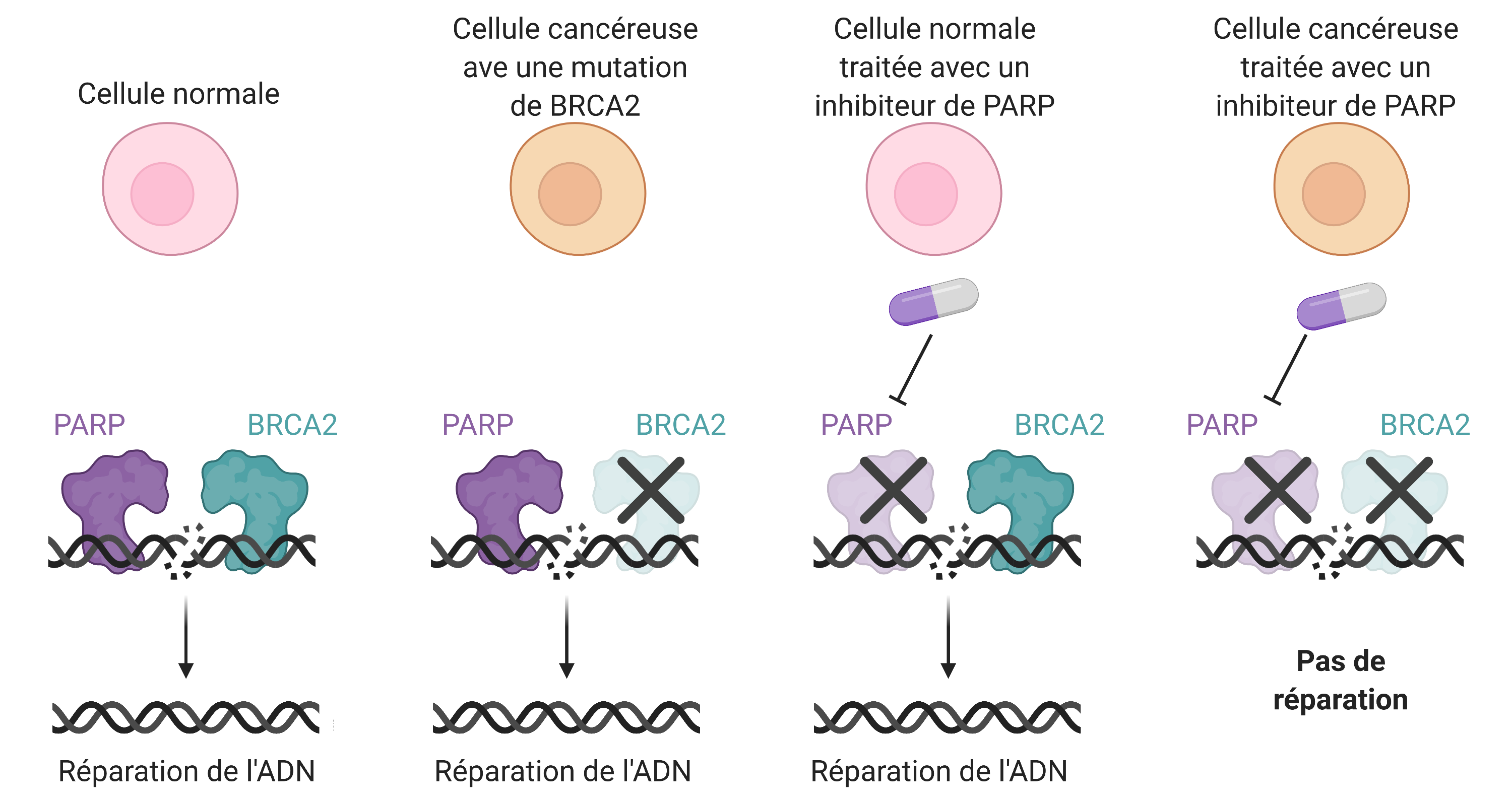
Après avoir étudié les mécanismes de réparation de l'ADN pendant plusieurs années, la médecine moderne a maintenant les moyens de lancer une attaque ciblée sur les tumeurs à haut taux de mutations, telles que celles qui ont une mutation de BRCA2.
Dans les cancers hébergeant une mutation de BRCA2, PARP1 est nécessaire pour maintenir un niveau minimal d'intégrité génomique. PARP1 est un contremaître épigénétique qui marque les protéines associées à l'ADN autour des sites de rupture pour recruter et organiser les protéines réparant la rupture, indépendamment de BRCA2. Sans cette coordination appropriée de la réparation de l'ADN par PARP1, les dommages restants dans l'ADN seraient réparés par le mécanisme dépendant de BRCA2. Mais si les deux sont manquants, les cellules sont envahies par les dommages à leur ADN et elles ne peuvent pas survivre. Une telle relation fatale entre deux protéines ou mécanismes est appelée létalité synthétique.
Suite à cette découverte, des chercheurs et oncologues ont développé des produits pharmaceutiques ciblant l'activité de PARP1. Ces inhibiteurs de PARP1 n'affectent pas gravement les cellules normales, car leur mécanisme de réparation de l'ADN intact peut surmonter la perte de PARP1. Cependant, dans les cellules cancéreuses au génome hautement instable, les inhibiteurs de PARP1 entraîneront des dommages mortels à leur ADN.
Les inhibiteurs de PARP ont déjà montré une grande efficacité en clinique pour certains cancers. Mais, PARP1 n'est pas le seul contremaître épigénétique coordonnant la réparation de l'ADN. Par conséquent, la recherche actuelle vise à identifier une nouvelle létalité synthétique entre des mutations conductrices spécifiques et des régulateurs épigénétiques de la réparation de l'ADN thérapeutiquement ciblables. Espérant que ces nouvelles approches thérapeutiques créeront une pression sélective insurmontable conduisant les dangereuses tumeurs génétiquement instables au bord de l'extinction.