Le potentiel de régénération musculaire est assuré épigénétiquement par la pause proximale au promoteur
Pour de nombreux gènes, le moment de l'activité transcriptionnelle est régulé épigénétiquement. L’un des mécanismes pour le réguler, la pause proximale au promoteur, consiste à positionner l'ARN polymérase II sur des sites spécifiques du génome afin que les gènes puissent être activés ou exprimés rapidement en réponse à des signaux de développement. Des recherches récentes montrent que le complexe NELF stabilise la pause proximale au promoteur pendant la régénération musculaire.
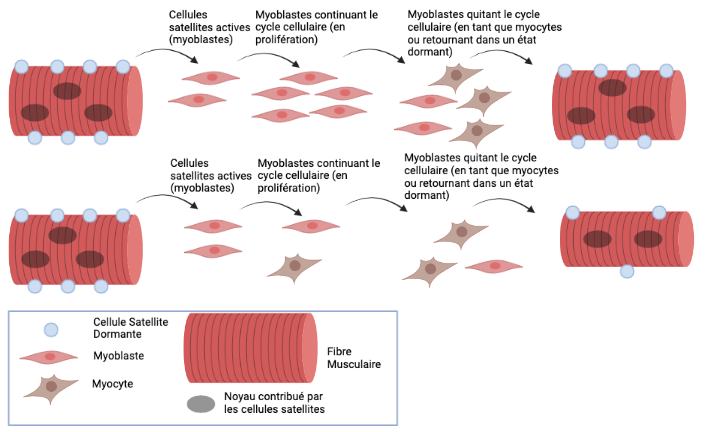
Les cellules satellites sont une population de cellules souches adultes dont la fonction principale est de réparer les tissus musculaires endommagés. Ces cellules restent dans un état de repos (ou « dormant ») avant les blessures musculaires. Dans cet état, les cellules satellites ne génèrent pas de nouvelles cellules et la taille de leur population reste statique.
Lorsque des blessures musculaires surviennent, les cellules satellites sont activées, entrant en état prolifératif sous forme de myoblastes pour générer suffisamment de cellules pour réparer le tissu endommagé. Les myoblastes continuent de proliférer pour accroître leur population jusqu'à ce que les signaux moléculaires fournis par le muscle en régénération leur disent de s'arrêter.
Lorsque les myoblastes sortent de cet état prolifératif, les mécanismes épigénétiques déterminent la suite. Ils seront soit 1) retourner à l'état de repos pour maintenir les cellules souches pour de futures blessures ; ou 2) fusionner pour former de nouvelles fibres musculaires dans un processus appelé différenciation terminale. L'un des mécanismes épigénétiques impliqués dans ce processus est la pause proximale du promoteur.
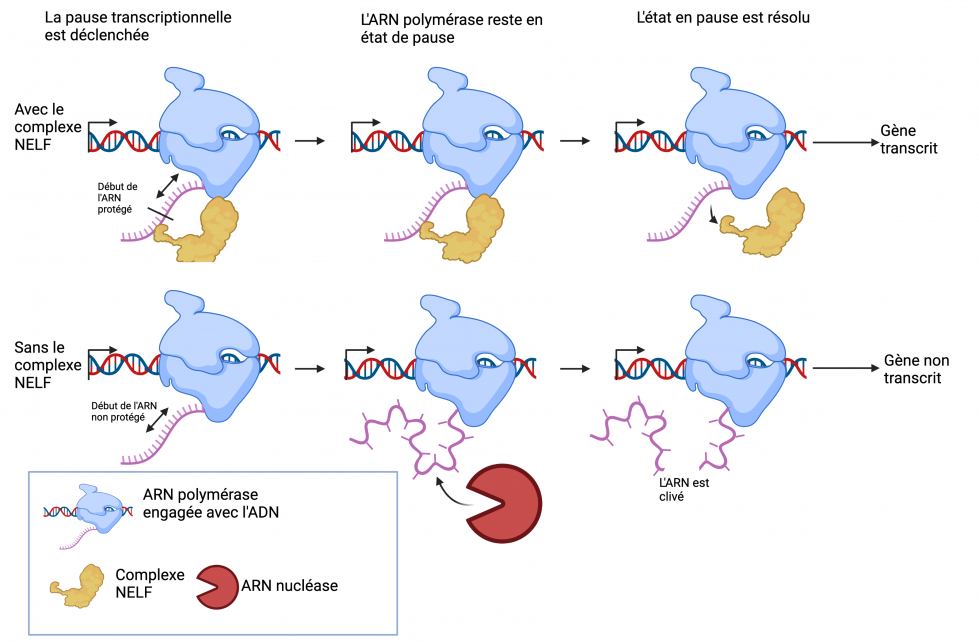
Pause proximale du promoteur
Pour de nombreux gènes, lorsque la transcription démarre, elle s'arrête rapidement. L’ARN polymérase II– une enzyme qui copie une séquence d'ADN en une séquence d'ARN–reste dans un état de pause en attente d'autres signaux pour commencer l'élongation complète. Cette pause permet une activation rapide des gènes lorsqu'ils sont enfin requis. Cependant, l'avantage de pouvoir activer un gène rapidement vient avec l'inconvénient que le court ARNm attaché à l'ARN polymérase II, lorsqu’elle est en pause, est facilement dégradé s'il n'est pas protégé.
Un complexe protéique clé impliqué dans la stabilisation de la pause proximale au promoteur est le Complexe Négatif de Facteur d'Élongation (NELF) qui agit pour protéger l'ARNm court attaché à l'ARN polymérase II en pause. Alors que la pause proximale au promoteur de l'ARN polymérase II requérant NELF est un processus bien connu pour réguler l'expression des gènes, il n'est pas clair comment les cellules souches musculaires adoptent ce mécanisme pour contrôler la réparation musculaire.
Le complexe NELF régule le potentiel prolifératif des myoblastes
Lorsque le gène NELF-b a été éliminé dans une étude réalisée par le laboratoire Dilworth, la capacité des myoblastes à proliférer a été altérée. Au lieu d'augmenter considérablement le nombre de cellules dans la population, une proportion inhabituellement élevée de myoblastes a été poussée vers la différenciation terminale au cours de chaque cycle de division cellulaire.
Les gènes nécessaires à la prolifération ont montré des niveaux d'expression réduits car l'ARN polymérase II était plus susceptible de se dissocier des gènes en l'absence du complexe NELF. Cela comprenait deux gènes clés pour la régulation du cycle cellulaire par p53 - SerpinF1 et Ccng1 - qui ont vu leur niveau d’expression être réduit.
La protéine p53 est connue comme un suppresseur de tumeur, car elle agit pour empêcher la prolifération. SerpinF1 (également connu sous le nom de PEDF) régule négativement l'expression de p53, et Ccng1 favorise la dégradation de la protéine p53. Lorsque NELF n'est pas présent, l'absence des protéines SerpinF1 et Ccng1 provoque l'accumulation de la protéine p53 dans les cellules satellites musculaires.
Alors, p53 empêche la prolifération des myoblastes pendant que les cellules sont forcées dans la différenciation terminale par l’absence de NELF. Bien que ces myoblastes deviennent des cellules musculaires, une réplication réduite des myoblastes entraîne la formation de moins de muscle dans l'ensemble.
Effet sur la régénération musculaire répétée
Un engagement excessif à la différenciation terminale dans les myoblastes dépourvus de NELF peut avoir un impact significatif sur la régénération musculaire tout au long de la vie d'un organisme. Dans des conditions normales, les myoblastes sains prolifèrent jusqu'à ce qu'ils aient assez de myoblastes pour réparer complètement le muscle endommagé. Les myoblastes inutilisés restants retournent ensuite à un état de repos pour conserver les cellules souches afin de réparer les futurs dommages musculaires. Cependant, lorsque la maladie empêche une bonne prolifération des myoblastes, trop peu de cellules régénératives sont présentes pour réparer correctement le muscle. Dans ces conditions, les myoblastes doivent tous être affectés à la réparation du muscle, laissant significativement moins de cellules disponibles pour rétablir la population de cellules souches, soulignant la nécessité d'une régulation épigénétique précise dans ce processus.
Une étude a démontré que la régulation épigénétique de la synchronisation transcriptionnelle dans les cellules satellites est essentielle pour une bonne régénération du muscle. L'un des mécanismes épigénétiques qui régule cette activité est le complexe NELF, qui permet d'arrêter temporairement la transcription par une pause proximale au promoteur afin que les gènes ciblés puissent être rapidement exprimés en cas de blessure.
En savoir plus (facultatif) :
L'article synthèse du laboratoire de Dr Lis décrit les preuves d'une pause proximale au promoteur ainsi que certains rôles connus et spéculatifs de ce processus.
L'article synthèse du laboratoire de Dr Adelman décrit le processus de pause proximale au promoteur en plus de détail.
Nous tenons à remercier Dr. Jeff Dilworth pour son avis d'expert sur cet article et Dr. Benjamin Lebeau pour la traduction Française.
Images créée danswww.BioRender.com