L'altération épigénétique de la jeune matière noire du sperme aggrave la fertilité sur deux générations successives.
Les éléments transposables, également appelés « gènes sauteurs », sont des segments répétitifs d'ADN viral qui se déplacent d'une position à une autre dans le génome. Des études sur l'hérédité épigénétique ont commencé à comprendre le rôle potentiel des jeunes éléments transposables par rapport à la transmission d’épimutations dans le sperme à la génération suivante.
Les modifications épigénétiques permettent de contrôler les éléments transposables pendant le développement de l'embryon.
Dans les cellules adultes saines, les éléments transposables sont généralement désactivés par la méthylation de l'ADN ou les modifications répressives des histones. La perte de ces marques épigénétiques a été associée au cancer, à la schizophrénie et à d'autres maladies complexes.
Au cours du développement de l'embryon, la plus grande partie de la méthylation de l'ADN est effacée dans les futurs spermatozoïdes et ovules de l'embryon. Cette vague de déméthylation de l'ADN réinitialise la méthylation de l'ADN des cellules reproductrices de l'embryon à un niveau fondamental. Cependant, certains éléments transposables doivent rester méthylés - ou éteints - pour ne pas nuire à l'embryon et à ses futurs gamètes.
L'altération de la méthylation de l'ADN dans les spermatozoïdes entraîne l'infertilité de la génération suivante.
La 5,10-Méthylènetétrahydrofolate réductase (MTHFR) est une enzyme importante qui aide à générer des groupes méthyle requis pour la méthylation de l'ADN et la méthylation des histones. Dans certaines populations humaines, les mâles qui ont une perturbation de leur enzyme MTHFR ont une méthylation de l’ADN anormale dans leur sperme et des problèmes de fertilité.
Dans une nouvelle étude, Dr. Gurbet Karahan et Dr. Jacquetta Trasler de l'Université McGill (Montréal) ont utilisé des modèles de souris pour étudier comment la déficience en MTHFR affecte la méthylation de l'ADN dans le sperme et la fertilité des mâles sur deux générations. Elles ont montré qu'un déficit en MTHFR chez les pères avait peu d'impact sur leur fertilité. Fait intéressant, les pères déficients en MTHFR ont donné naissance à des fils avec des fonctions reproductives anormales.
Les auteurs se sont ensuite demandé si les niveaux de méthylation de l'ADN étaient altérés dans le sperme des pères déficients en MTHFR et de leurs fils. Ils ont découvert une vaste perte de méthylation de l'ADN dans leur sperme. Étonnamment, plus de 80% des sites qui ont perdu la méthylation de l'ADN chez les pères MTHFR, ont également perdu la méthylation de l'ADN chez leurs fils.
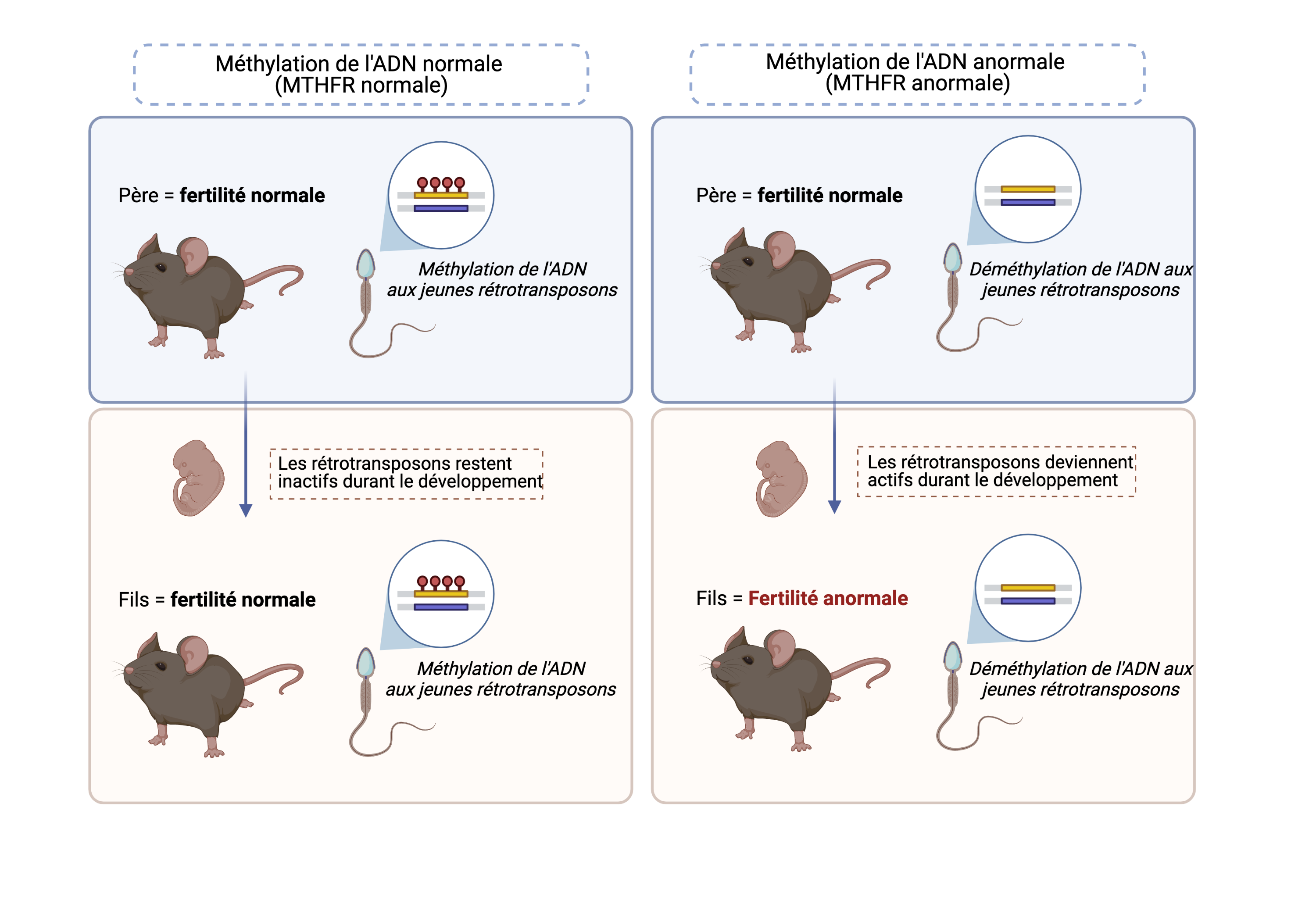
La perte de méthylation de l'ADN dans le sperme se produit dans les jeunes rétrotransposons.
Curieusement, la plupart des pertes de méthylation de l’ADN dans les spermatozoïdes ne se sont pas produites au niveau des gènes codants, mais plutôt dans la « matière noire » non codante du génome. Plus précisément, les auteurs ont découvert que le sperme des pères déficients en MTHFR et de leurs fils perdait la méthylation de l'ADN au niveau des jeunes rétrotransposons. Les rétrotransposons sont une classe d'éléments transposables qui se copient-collent dans le génome via un intermédiaire d’ARN et peuvent être dangereux pour les cellules lorsqu'ils sont actifs. Les jeunes rétrotransposons sont particulièrement nocifs car ils n'ont pas encore accumulé suffisamment de mutations d’ADN pour devenir cooptés et bénéfiques par l'hôte.
La perte de cette marque épigénétique répressive au niveau des éléments transposables qui doivent généralement rester silencieux pendant le développement de l'embryon, peut conduire à une activation aberrante de ces éléments transposables et expliquer en partie la baisse de la fertilité dans deuxième génération de mâles. Cette étude suggère que les jeunes rétrotransposons peuvent faciliter la transmission des épimutations des pères aux fils.
Learn more
- Une synthèse complète des différentes classes d'éléments transposables: “Transposons: the jumping genes.”
- Une revue soulignant comment les éléments transposables peuvent affecter la stabilité du génome mais aussi agir en tant qu'innovateurs génétiques: “Transposable elements shape the evolution of mammalian development.”
- Une perspective discutant de la sensibilité des éléments transposables à l'environnement: “Adaptation to global change: a transposable element-epigenetics perspective.”
Nous tenons à remercier Dr. Gurbet Karahan, Dr. Jacquetta Trasler et Dr. Sarah Kimmins de l'Université de McGill pour la révision de set article.

