Pelage de chat et daltonisme : ce que l'inactivation du chromosome X nous enseigne sur notre santé.
Connaissez-vous le point commun entre la fourrure des chats et le daltonisme ? La réponse se trouve dans l'épigénétique. Explorons un mécanisme appelé « inactivation du chromosome X » et ses implications sur la santé.
X et Y : que sont les chromosomes sexuels ?
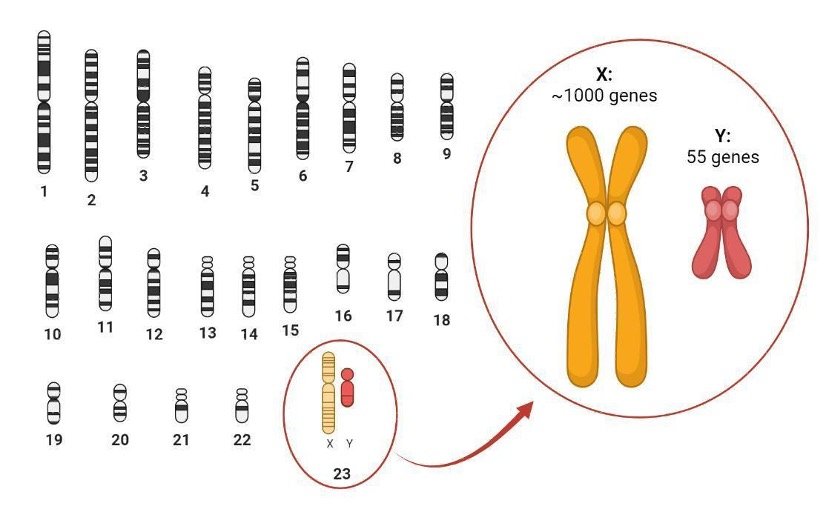
Tout d'abord, il faut comprendre ce que sont les chromosomes. Le noyau de nos cellules contient l'information génétique que nous héritons de nos parents. Ce matériel génétique est fait d'ADN et contient des milliers de gènes qui régulent un grand nombre de nos traits physiques, tels que notre taille, notre groupe sanguin ou la couleur de nos yeux. Et tout comme une encyclopédie peut être divisée en plusieurs volumes, notre ADN est divisé en chromosomes. Les êtres humains possèdent 23 paires de chromosomes – une série complète étant hérité de chaque parent.
Une paire de chromosomes se distingue en particulier par le fait qu'elle comprend deux types de chromosomes, X et Y, dont la taille et le contenu varient considérablement (figure 1). Le sexe biologique est généralement déterminé par le chromosome Y, qui est relativement petit et ne contient que 55 gènes chez les humains, soit une fraction du millier de gènes présents sur le chromosome X. Contrairement aux autres paires de chromosomes, desquelles les mammifères possèdent 2 copies de chaque gène, le nombre de copies de gènes porté par les chromosomes sexuels varie. Les individus XY auront une seule copie de la plupart des gènes liés au chromosome X, tandis que les individus XX auront deux copies de chaque gène.
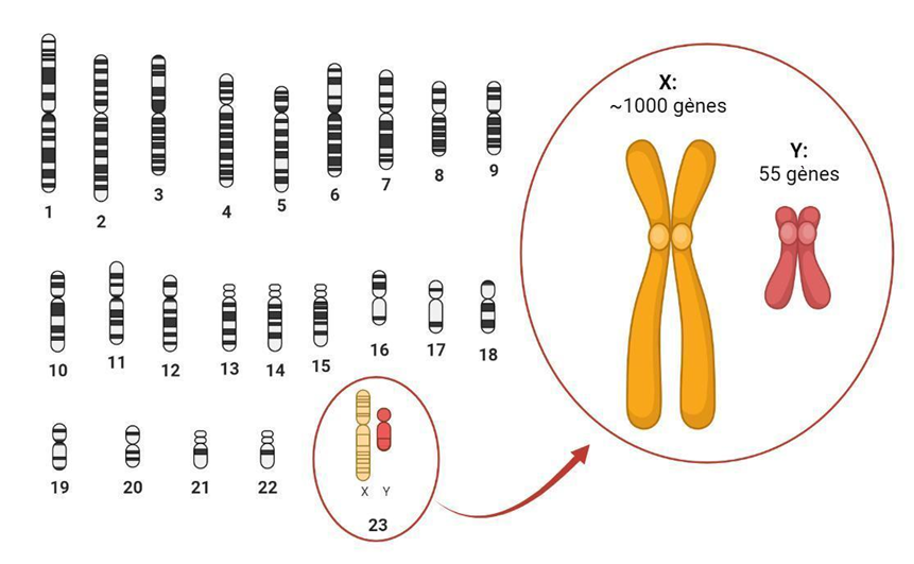
En général, posséder des chromosomes supplémentaires ou manquants peut s’avérer très néfaste pour une cellule. En effet, avoir deux copies du chromosome X signifie une double dose d'activité pour les gènes du chromosome X par rapport aux cellules XY. Étonnamment, les individus XX utilisent un mécanisme épigénétique pour corriger ce déséquilibre ! Au cours du développement embryonnaire, les cellules porteuses de deux chromosomes X désactivent une copie - un processus appelé « inactivation du chromosome X » (ICX) - tandis que l'autre copie reste active.
L'inactivation du chromosome X (ICX)
L’ICX est un exemple typique de mécanisme épigénétique : elle ne modifie pas la séquence d'ADN en tant que telle mais affecte la façon dont les gènes sont interprétés par la cellule, et ce changement est transmis aux cellules filles. Le processus d’ICX est également appelé « lyonisation », d’après Mary F. Lyon, la généticienne qui a découvert ce phénomène pour la première fois.
Pour comprendre l’ICX, il faut d'abord se rappeler que l'ADN n'est pas "nu" dans le noyau de nos cellules. Il est enroulé autour d'un ensemble de protéines appelées histones, comme un fil à coudre autour d'une bobine. L'ajout ou la suppression de petites modifications chimiques à ces histones ou à l'ADN peut avoir un impact sur l'activité des gènes situés à proximité. Ces modifications constituent un pilier de la régulation épigénétique.
Le processus de l’ICX est initié par la production d'un ARN spécifique appelé XIST, qui recouvre presque entièrement le chromosome X. XIST recrute à son tour la machinerie épigénétique, qui va ajouter les modifications chimiques aux protéines histones situées sur le chromosome X ciblé. Ces modifications poussent le chromosome X à s'enrouler sur lui-même et à se condenser en une petite structure compressée. Le résultat est une masse compacte, appelée « corpuscule de Barr », qui est en grande partie inactive. Comme un des chromosomes X est maintenant réduit au silence, le problème de la double dose toxique de gènes est résolu.
L’ICX survient très, très tôt dans le développement embryonnaire. Lorsque le processus se met en marche, les cellules embryonnaires choisissent au hasard l'un des deux chromosomes X à inactiver (figure 2). Comme toutes les cellules ne désactivent pas le même chromosome, l'embryon devient une mosaïque cellulaire : la copie paternelle est désactivée dans certaines cellules, tandis que la copie maternelle l’est dans d'autres. Et une fois que ce choix est fait, il est maintenu de manière stable dans toutes les cellules filles créées par de futures divisions cellulaires. Par conséquent, ce mécanisme précoce de sélection peut entraîner des conséquences à très long terme.
La science de la couleur des chats
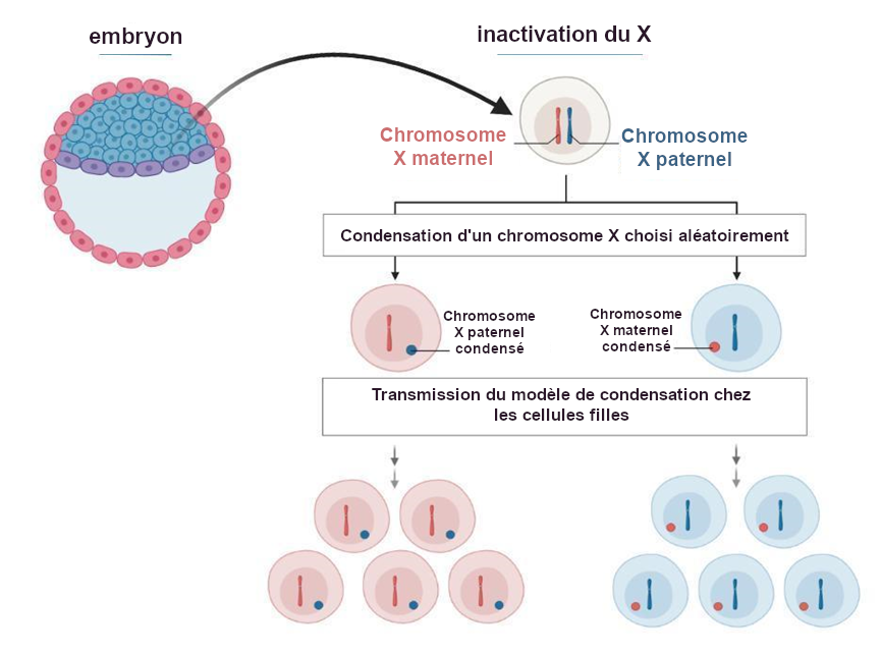
L'une des meilleures illustrations du mosaïcisme cellulaire résultant de l’ICX n’est autre que la couleur de la fourrure des chats. Tous les gènes peuvent exister dans des versions très légèrement différentes d’un individu à l’autre. Pour les chats, il existe un gène avec deux variantes de couleur de fourrure - orange ou noire. Les chats « écailles de tortue » et « calicos » possèdent tous les deux un pelage multicolore portant des taches aléatoires oranges et noires, avec en plus des taches blanches pour les chats calicos. Or, le gène qui contrôle la pigmentation orange ou noire de la fourrure se trouve en fait sur le chromosome X et est donc soumis à l'influence de l’ICX.
Ce mélange de couleurs orange et noire se produit exclusivement chez les chats femelles, qui possèdent deux chromosomes X (figure 3). Un chromosome X peut donc porter la version du gène codant pour la coloration orange, et l'autre chromosome X la coloration noire. Comme mentionné précédemment, un seul de ces chromosomes X sera actif dans chaque cellule, selon le choix aléatoire qui se produit au cours du développement embryonnaire. Par exemple, les cellules situées à la base de la queue peuvent avoir le chromosome X paternel actif et présenter une coloration orange, tandis que les cellules situées à l'extrémité de la queue peuvent avoir le chromosome X maternel actif et produire une fourrure noire.
En d'autres termes, la fourrure du chat est une mosaïque de couleurs qui reflète l'inactivation aléatoire du chromosome X, qui est dirigée par des mécanismes épigénétiques et se produit au cours du développement embryonnaire précoce.
La présence supplémentaire de taches blanches chez les chats calico n'est en revanche pas sous le contrôle du chromosome X. Cette condition appelée « piébaldisme », qui entraîne une absence de pigmentation de la peau et du pelage, est courante aussi bien chez les chats XX que XY. Vous avez probablement souvent vu des pattes blanches sur des chats de couleurs diverses.
Inactivation du X et santé chez les humains
L’ICX révèle des mécanismes qui vont bien au-delà des couleurs de nos animaux de compagnie. En particulier, lorsque des maladies sont causées par des mutations dans les gènes situés sur le chromosome X (aussi dites « liées au chromosome X »), celles-ci sont soumises au même type de régulation que précédemment décrit pour la couleur du pelage des chats. Examinons ensemble comment l’ICX peut avoir un impact sur certaines maladies humaines.
L'un des exemples les plus courants de trouble lié au chromosome X est le daltonisme rouge-vert (figure 4). Cette affection est causée par des mutations dans les protéines appelées opsines qui absorbent la lumière dans la rétine et nous aident à percevoir une gamme de couleurs. L'un des gènes des opsines est situé sur le chromosome X. Chez les individus XY, qui ne possèdent qu'une seule copie du chromosome X, une seule mutation suffit à rendre cette personne daltonienne. Cependant, les individus XX possèdent deux copies du chromosome X, mais une seule est active dans chaque cellule. Si l'un de ces chromosomes présente une mutation du daltonisme, environ la moitié des cellules du corps utiliseront la version saine du gène de l'opsine, et l'autre moitié la version mutée. Dans la plupart des cas, le fait d'avoir les bonnes opsines dans une moitié des cellules de la rétine est suffisant pour voir correctement les couleurs. Le daltonisme est donc beaucoup moins fréquent chez les femmes.
Il est toutefois possible pour des individus XX d’être daltonien même avec un seul chromosome X muté. Cela est dû à la nature aléatoire du choix du chromosome qui est désactivé au cours du développement embryonnaire. Si, en moyenne, 50% de chaque X est choisi globalement, il est possible que cette distribution soit biaisée en faveur d'une copie particulière du chromosome. Par exemple, si une personne a par hasard 90% du X muté actif dans son corps, elle peut développer un daltonisme bien qu'elle soit XX (figure 4).
Au-delà du daltonisme, il est désormais connu que de nombreuses maladies et troubles de la santé sont influencés par l’ICX, y compris des formes d'hémophilie, de dystrophie musculaire et d'immunodéficience. Ainsi, la mise sous silence du chromosome X par des mécanismes épigénétiques a des répercussions importantes en matière de génétique, de santé et de maladies.
Learn more:
-
Explication détaillée de l’ICX : https://planet-vie.ens.fr/thematiques/genetique/l-inactivation-du-chromosome-x-chez-les-femelles-de-mammiferes
-
Un autre exemple de trouble lié au chromosome X, l’hémophilie : https://www.hemophilia.ca/fr/lheredite-de-lhemophilie/Review on XCI for a broad audience: https://kids.frontiersin.org/articles/10.3389/frym.2019.00134
Images creer dans www.BioRender.com
Références:
- Lyon, MF. Sex chromatin and gene action in the mammalian X-chromosome. Am. J. Hum. Genet. 1962; 14:135–48.
- Loda A, Collombet S & Heard E. Gene regulation in time and space during X-chromosome inactivation. Nat Rev Mol Cell Biol. 2022; 23(4):231-249. doi: 10.1038/s41580-021-00438-7.
- Pessia E, Makino T, Bailly-Bechet M, McLysaght A & Marais G.A.B. Mammalian X chromosome inactivation evolved as a dosage-compensation mechanism for dosage-sensitive genes on the X chromosome. Proc. Natl Acad. Sci. USA. 2012; 109, 5346–5351.
- Brown CJ et al. The human XIST gene: analysis of a 17 kb inactive X-specific RNA that contains conserved repeats and is highly localized within the nucleus. Cell. 1992; 71, 527–542.
- Dixon-McDougall T & Brown C. The making of a Barr body: the mosaic of factors that eXIST on the mammalian inactive X chromosome. Biochem Cell Biol. 2016; 94(1):56-70. doi: 10.1139/bcb-2015-0016.
- Augui S, Nora EP & Heard E. Regulation of X-chromosome inactivation by the X-inactivation centre. Nat. Rev. Genet. 2011; 12, 429–442.
- Malcom K. How one of the X chromosomes in female embryonic stem cells is silenced ScienceDaily. 2022. https://www.sciencedaily.com/releases/2022/05/220519115328.htm.
- Cloutier M, Kumar S, Buttigieg E, Keller L, Lee B, Williams A, et al. Preventing erosion of X-chromosome inactivation in human embryonic stem cells. Nature Communications. 2022; 13. doi: 10.1038/s41467-022-30259-x
- Pereira G & Dória S. X-chromosome inactivation: implications in human disease. J Genet. 2021; 100:63.
- Singer-Sam J. Monoallelic Expression. Nature Education. 2010; 3(3):1. https://www.nature.com/scitable/topicpage/monoallelic-expression-881327….
- Niemi S & Wu H. X Marks the Spot: How X Chromosome Inactivation Gives Females an Advantage. Front. Young Minds. 2019; 7:134. doi: 10.3389/frym.2019.00134.
- Slutz S. 2019. X-inactivation Marks the Spot for Cat Coat Color. Science Buddies. https://www.sciencebuddies.org/science-fair-projects/project-ideas/MamB….